連載「博士のホップノート」|第5章 ホップの進化遺伝学
第5章 ホップの進化遺伝学
ホップはいったいいつ、どこで誕生したのだろう。
しかし、その起源を明確に教えてくれる資料はありませんでした(鏡ら1985)。記憶の中では、「不明」や「ヨーロッパあるいはコーカサス地方(黒海・カスピ海周辺)」と、漠然と書かれた本もあったように思います。要するによく分かっていないのです。
そんなある日、たまたま車で通りかかったときに、目に飛び込んできたのです。野生のホップでした。確か1998年の秋、岩手の新幹線・水沢江刺駅の南側に位置する丘の中腹でのことです。
「こんなに身近にいるのか」と驚くと同時に、「この辺はホップの産地だから、昔はホップ畑だったのかもしれない」と思いました。最初のうちはそう考えていたのです。
ところが、その後いろいろな場所で、畑などあるはずのない山間部の絶壁でも、野生のホップが目に入ってくるではありませんか。
「はて、このホップはいったいどこから来たのだろう」
そう思った瞬間から、ふつふつと湧き上がる興味は次第に膨らみ、「ホップの起源はどこか」「どのようにして北半球に広がったのか」知りたいという強い思いへと変わっていきました。
思い立ったは良いものの、そこには二つの大きな課題がありました。
ひとつは、どうやって調べれば良いのか。
これは、後にDNAを調べればよいことが分かりました。
もうひとつは、世界中の野生ホップを集めなければならないということです。
この難題は、世界各地のホップ研究仲間が助けてくれました。
分子進化遺伝学
「ミトコンドリアのイブ」の話をご存じない方も多いと思います。当時はメディアでも取り上げられ、大きな話題となった研究です。
人間の起源はアフリカにあり、約16±4万年前に存在した一人の女性に辿り着く、という内容でした(詳細はウィキペディアなどを参照のこと)。この論文が掲載されたのは、世界的に有名な科学雑誌『Nature』(1987年)です。まさに超一流の研究成果といえます。
では、何をどのように調べれば、そんな結論に辿り着けるのでしょうか。
研究者たちはミトコンドリアDNAの配列を調べたのです(当時はDNA断片多型を利用)。ミトコンドリアDNAは母親のみから受け継ぐものであり、核DNAのように父母の両方から遺伝するものではありません。植物でも同様で、ミトコンドリアDNAは雌親から伝わります。さらに、植物が光合成を行う葉緑体のDNAも、同じく雌親由来です。
核の遺伝子は、突然変異や染色体の組み換え、遺伝子の転移(トランスポゾン)などによって変化します。一方、細胞質に存在するミトコンドリアや葉緑体の遺伝子は、自然に起こる突然変異のみで変化します。多くの人々のミトコンドリアDNAを解析し、その違いを統計的に処理した結果、先の結論に辿り着いたわけです。
DNAを調べるだけで、これほど壮大なことが分かってしまう。その事実には本当に興奮します。
この成果の背景には、分子進化遺伝学という確かな学問基盤と、DNA解析技術の著しい進歩があったのです。
DNAを構成する塩基、A(アデニン)、G(グアニン)、C(シトシン)、T(チミン)の違いを調べるのですが、まずは単純に、どれだけの塩基が異なっているかを数えます。異なっている数が多いほど遠縁、少ないほど近縁という関係になります。
ただし、単純に数を比べるだけでは不十分です。たとえば、稀にしか起こらない塩基の変異と、頻繁に起こる変異を同じ重みで扱うことはできません。発生する確率が異なるためです。そこで、変異の頻度を補正した尺度を用います。それが「塩基置換率」と呼ばれる統計量です。
塩基置換率は分散を求めることもできるため、有意差の統計的検定も可能です。この値によってDNAの類縁関係、つまり近いか遠いかの関係を定量的に示すことができ、調べた対象(人間など)の関係を「系統樹」という図で表すことができます。分子進化遺伝学は、このようにDNAの違いから進化の系譜を教えてくれます。
「ミトコンドリアのイブ」の研究では、最初の分岐がアフリカ集団とアフリカ以外の集団との間で起こっていることが示されました。さらに、アフリカ集団のほうがDNAの多様性が大きいという結果も得られています。これが人類のアフリカ起源説を支える根拠です。
一般に、起源の地では遺伝的多様度が高いといわれます。起源にある集団は最も古い世代を持つため、進化の過程でDNAの変異を多く蓄積しているからです。こうして最も古い女性由来のDNAに辿り着く。それが「ミトコンドリアのイブ」です。
この項の冒頭で触れた「16±4万年前」という年代は、「分子進化時計」という仮説をもとに計算されたものです。詳細は後ほど説明します。
PCRの登場
分子進化遺伝学はもともと、タンパク質のアミノ酸配列の違いやDNA断片長の違いなどを解析するために、統計的な尺度を与える理論として始まったようです。
DNAの塩基配列の違いを直接解析する手法が登場するのは、ずっと後のことでした。
当時、DNAの塩基配列を調べるのは非常に大変でした。DNAを取り出すには大量の試料が必要であり、塩基の並びを決定する作業もとにかく煩雑だったのです。特別な実験設備も必要でした。
そして1983年、生命科学の歴史を変える大革命が起こります。
ポリメラーゼ・チェーン・リアクション(Polymerase Chain Reaction: PCR)の登場です。
現在では新型コロナウイルスの検査方法として広く知られるようになったPCRですが、もともとはDNA研究を一変させた技術でした。
この方法の画期的な点は、DNAを増やせることにあります。大量の試料を必要とせず、少量のDNAから目的の領域だけを増幅できるのです。原理は、生物が本来もっているDNAの複製機構です。細胞分裂の際に行われるDNA複製を、人為的に再現しているわけです。しかも、見たいDNAの部分だけを選んで、何百万倍にも複製できるのです(ノート5-1)。
この原理を考案したのは、アメリカのキャリー・マリス博士でした(1983年)。
その後、1987年に自動反応装置が開発され、一気に普及が進みます。簡単で、安価で、手軽に扱えるDNA解析技術として、多くの研究者が利用するようになりました。
PCRはその功績により、1993年にノーベル化学賞を受賞しています。
それほどまでに画期的な技術だったのです。
PCRは新型コロナウイルス感染を高感度で検出できる診断検査技術として広く知られていますが、その用途はそれだけではありません。DNAの塩基配列を決定する際にも、PCRは欠かせない技術として大活躍しています。
学生時代、ヒトの全ゲノムの塩基配列を読み取るには、いったい何年かかるのだろうと思っていました。それが、PCRの登場によって、驚くほど短期間で達成されてしまったのです。
いまではヒトに限らず、さまざまな生物の全ゲノム情報が明らかになっています。もちろん、ホップも例外ではありません。すでにNatsumeら(2015)によって、ホップのゲノム解読は完了しています。
分子進化時計
ヒトの進化を表した系統樹を見たことがあると思います。ヒト、チンパンジー、ゴリラ、オランウータンが枝分かれした分岐図です。この分岐の年代を推定する方法があります。
ノーベル賞を二度受賞したポーリング博士は、さまざまな生物の特定のタンパク質についてアミノ酸配列を調べたところ、アミノ酸の置換速度がほぼ一定であるらしいことを最初に報告しました(Nei and Kumar 2000)。もし一定の速度が存在するなら、アミノ酸置換率から進化上の分岐年代を推定できることになります。
しかし、ここで論争が起こります。生物の種類によって寿命や繁殖回数が異なるため、変異が子孫に伝わり、さらに集団全体に広がる速度も異なるはずです。したがって、「アミノ酸変異の程度が時間に比例し、年あたりの置換速度が一定である」という考え方には無理があるのではないか、と議論されたのです。
1980年代に入り、DNAに関する情報が大量に得られるようになると、塩基置換率にも一定の速度があることが明らかになり、論争はさらに活発になりました。では結論はどうかというと、今のところ決着はついていません。現在では「分子進化時計仮説」と呼ばれています。
仮説とはいえ、この考え方に基づいて進化上の分岐年代を推定した論文は数多く発表されています。それほど分子進化時計の発想は魅力的なのです。DNAの塩基配列という分子レベルの情報から、「年代」という時間軸へと拡張できること。これは、過去に何が起こったのかを地球規模で考察する手がかりを与えてくれます。
もちろん、慎重さも必要です。DNA塩基置換速度の等速度性を検定するなど、データを丁寧に解析するための統計ツールも整備されています。
DNAを調べれば、ホップの進化についても何らかの手がかりが得られるに違いない。
DNA塩基配列を調べることは、PCRのおかげで今では容易です。
次の課題は、世界の野生ホップをどうやって集めるかということになります。
野生ホップ収集開始
日本の野生ホップは自分で採取すれば良いとして、問題は世界の野生ホップをどう集めるか、ということでした。
当然、一人では無理です。そこで頼ることにしました。ホップの国際専門学会、育種の章でも触れた学会です。正式名称は Scientific Commission of International Hop Growers Convention。
事務局はドイツ・バイエルン州立農業試験場の Hüll 研究所、つまりドイツのホップ専門研究所に置かれています。学会は主にヨーロッパ各地で、2年ごとに開催されています。
ここで知り合った研究仲間たちに協力をお願いしました。研究の目的と手法を説明し、各国の研究所で遺伝資源として大切に保存しているであろう野生ホップの葉、もしくは毬花を送ってほしいと頼んだのです。2000年のことでした。
ほどなくして試料が届き始め、2001年にはすべて揃いました。快く応じてくれたことが本当にうれしかった。みんな研究仲間としての信頼関係を築いてきたからこそだと思います。温かいものを感じました。
送られてきた試料の多くは自然乾燥でしたが、ドイツからは凍結乾燥されたものが届きました。DNAを抽出しやすいようにとの配慮です。凍結乾燥は手間がかかる処理であり、その心遣いがありがたかった。
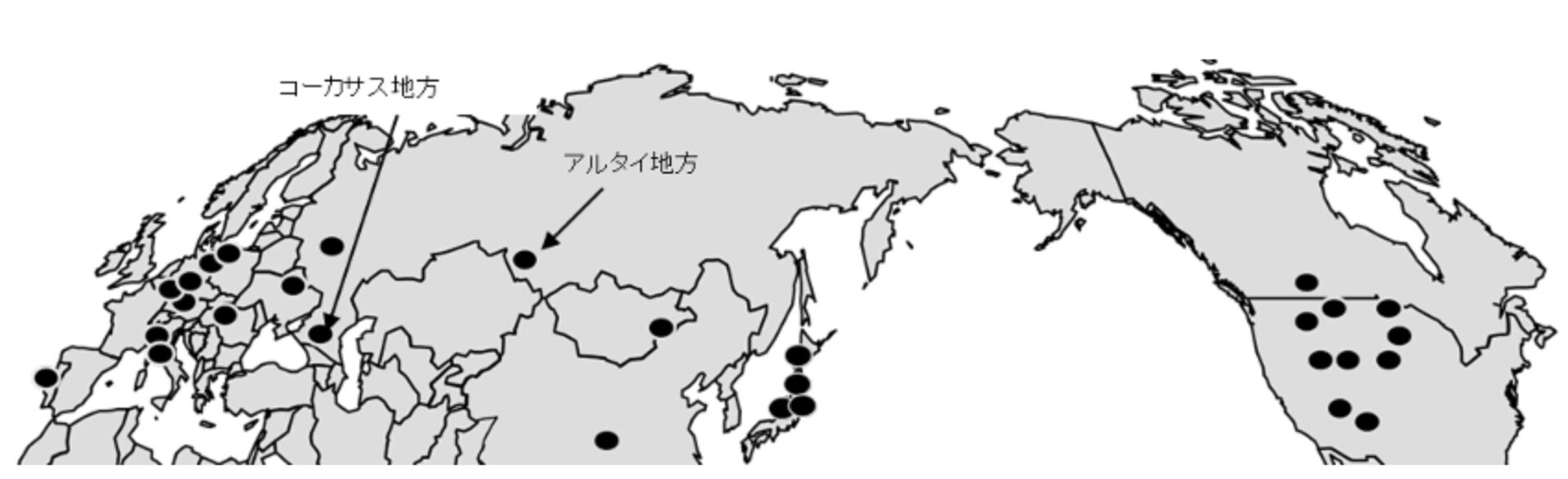
さらに、ワシントン州立大学の Steve Kenny 氏から送ってもらった北米の野生ホップも含め、最終的に115点の試料が揃いました。
これらのサンプルの出自を示したのが図5-1です。ユーラシア大陸から北米大陸までを広く網羅しており、黒海・カスピ海周辺のコーカサス地方、ロシア、カザフスタン、中国、モンゴル国境近くのアルタイ地方といった、簡単には行けない地域の試料も含まれていました。まさに貴重なコレクションです。
中国のサンプルは、かつて別の研究機関に所属していた方のご厚意によるもので、内モンゴル自治区北部と四川省南部の野生ホップでした。
日本の野生ホップについては、北海道から長野県まで、2年をかけて自ら収集しました。さあ、いよいよDNAの解析です。
世界の野生ホップのDNA解析
研究を進めるうえで、ゲノム上のどの領域のDNAを、どの程度の長さ(DNA塩基数)で解析のターゲットとするかは、非常に重要な課題です。
事前に何年も実験を重ねて分かっていたのは、野生ホップ同士はかなり近縁であり、DNA塩基の違いはそう簡単には見つからないだろうということでした。
分子進化時計仮説を用いて各地の野生ホップの分岐年代を推定したかったため、統計的に有意な差を検出できるだけの解析精度が必要でした。1個や2個の塩基の違いでは誤差の範囲に埋もれてしまい、統計的に意味のある結果は得られないことがわかっていたのです。
解析のターゲットに選んだのは、葉緑体DNAの非コード領域でした。これはアミノ酸をコードしていないDNA領域で、遺伝子と遺伝子の間にある「スペーサー領域」とも呼ばれる部分です。変異が起きてもアミノ酸配列や形質(表現型)には影響しないため、DNA変異が比較的起こりやすく、また蓄積されやすい領域とされています。
最終的に12か所の領域を解析し、総塩基数は8,200を超えました。以降、塩基数は通例に従い bp(base pair)または kb(1 kb = 1,000 bp)で表記します。1試料あたり約8.2 kbという長さは、2000年代前半としてはかなりの解析規模でした。
しかし、検定の結果、12か所のうち2か所に異常が見つかりました。ヨーロッパ集団のみ、特定の2領域で変異が異常に多かったのです。このため、分子進化時計の前提が成立せず、その部分のデータを除外しました。最終的には、信頼性の高い約7 kbのデータを用いて解析を行いました。
Humulus属の構成
解析の詳細に入る前に、Humulus属の構成について説明しておきます(表5-1)。
以下では、H.はHumulusの略号として用います。学名はイタリック体で表記します。
ホップの属するHumulus属はH. lupulus、H. japonicus、そして H. yunnanensisの3種から構成されています(Neve1991)。
H. japonicusは一年生植物で、和名をカナムグラといいます。中国、韓国、日本に自生しており、染色体数がホップ(H. lupulus)とは異なるため、両者の間で受粉・受精は起こりません。
一方、H. yunnanensisは中国雲南省、北緯25度付近の高地に自生していると報告されています。Boutain(2014)によれば、H. yunnanensisはH. japonicusに比較的近縁であるとされています。

H. lupulusは、「種」以下の分類レベルでさらに細分化されてます。変種を示す場合には、var.(=variety)という表記を用います。
ヨーロッパのホップはH. lupulus var. lupulus、アメリカの野生ホップは形態的特徴の違いから、H. lupulus var. neomexicanus、 H. lupulus var. pubescens、およびH. lupulus var. lupuloides の3種に分類されています。
日本の野生ホップはH. lupulus var. cordifolius に分類され、和名はカラハナソウです。Neve(1991)は、形態的特徴およびY染色体構造の類似性から、アメリカと日本の野生ホップが比較的近縁な関係にあり、ヨーロッパのホップとは異なることを報告しています。
DNA塩基の違い
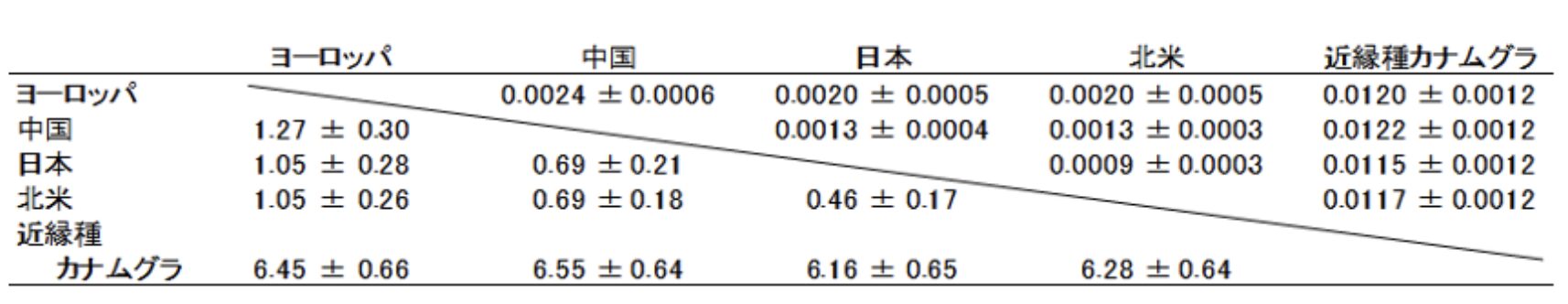
ヨーロッパ、中国、日本、北米の各ホップ集団は、有意に異なるDNA塩基配列を持っていました。
それぞれの特徴を簡単に示します。
(1)ヨーロッパ集団は、アルタイ地方からポルトガルまで同じDNA型が広く分布していました。ただし、コーカサス地方では1塩基だけ異なるホップが見つかりました。
(2)中国集団は、北部と南部で2塩基異なる2つのグループに分かれていました。
(3)日本集団は単一のDNA型で構成されていました。
(4)北米集団は多様性が高く、平均3.67塩基異なる3つのグループに分類されました。先述した3変種に対応している可能性がありますが、いずれにしてもDNAの多様性は他地域より明らかに高い結果でした。
これらを合計すると、(1)+(2)+(3)+(4)= 2+2+1+3 = 8種類の葉緑体DNAタイプに分けられたことになります。
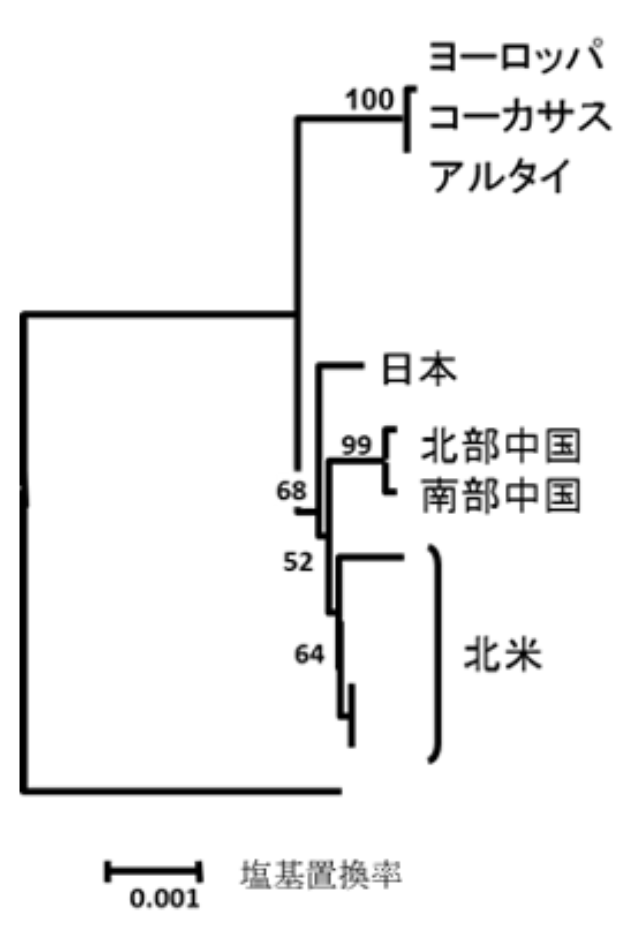
次に、これら8種類の類縁関係を解析しました。H. lupulus 内での関係を検討するため、外群として近縁種 H. japonicus のデータを加えて計算しました。
解析結果は系統樹(phylogenetic tree)として出力されます。これは類縁関係を反映した図であり、H. japonicus との分岐が最も古く、そこが系統樹の「根(root)」となります。
結果を図5-2に示します。最初に分岐したのは、コーカサス地方を含むヨーロッパ集団のDNAでした。残る中国、日本、北米のDNAは、さらに2回の分岐によって3つの地域に分かれると考えられます。
図5-2では、日本が最初に分かれ、次いで中国と北米に分かれているように見えますが、統計的には有意ではありませんでした。図中の数字は分岐の信頼度(bootstrap値)を示しており、少なくとも80以上、できれば90以上が望ましいとされます。しかし、実際の値は60〜50台にとどまり、分岐の順序を明確に決定することはできませんでした。
ホップの起源の地
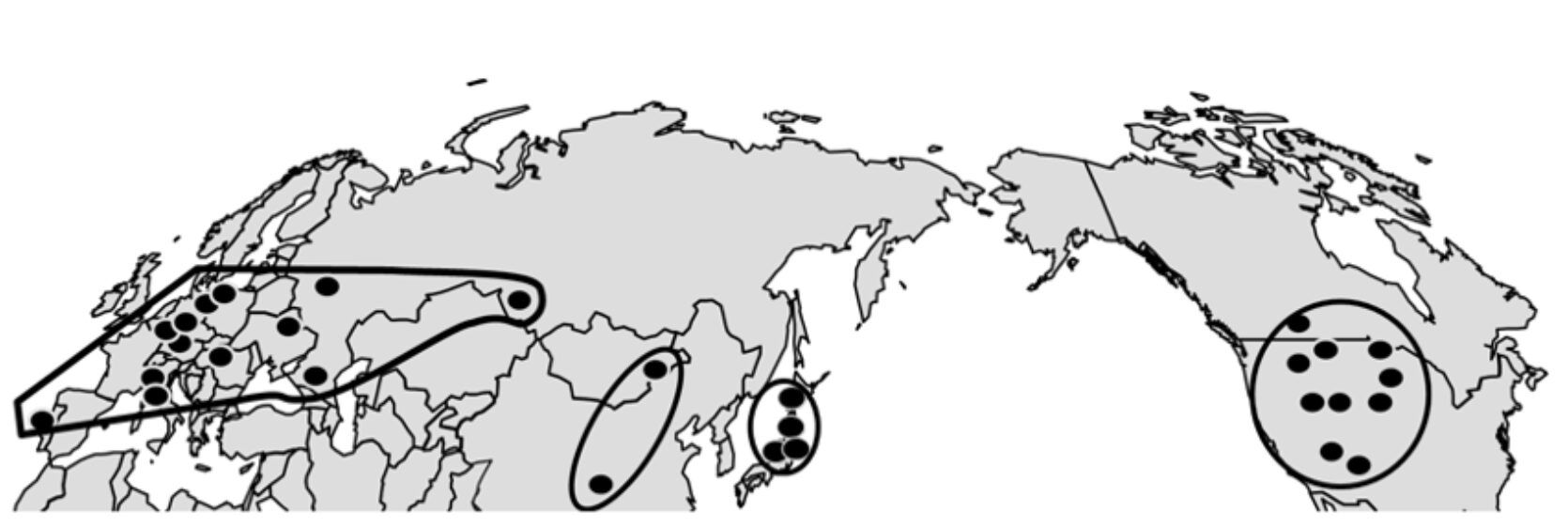
葉緑体DNAの地理的分布を示したのが図5-3です。系統樹の解析では、最初にヨーロッパのホップとそれ以外のホップが分岐していました。この最初の、そして最も深い分岐が起こった場所こそ、ホップの起源の地に近いと考えられます。
では、地図上で確認してみましょう。
アルタイ地方にはヨーロッパ型のDNAが分布していましたが、その近くに位置する中国西部・新疆のホップもヨーロッパ型であることが、Pillay and Kenny(1996)による核DNAの研究でも確認されています。したがって、最初の分岐が起こった場所は、中国の中央部から東部にかけての地域である可能性が高いと考えられます。
Neve(1991)はHumulus属の起源の地を次のように語っています。
The occurrence of three species in China suggests very strongly that this area is the centre of origin of the genus.
H. lupulus、H. japonicusとH. yunnanensisが自生している場所、つまりはHumulus属の多様性が最も高い場所こそが起源の地であり、それが中国である、としました。今回のH. lupulus内の最初の分岐はユーラシア大陸中央部から東部の内陸部と推定され、ヨーロッパ、中国、日本のそれぞれのタイプが集まっている場所がH. lupulusの起源の地であり、それもまた中国となるのです。
H. lupulus、H. japonicus、そして H. yunnanensis がいずれも自生している場所、すなわち Humulus 属の多様性が最も高い地域こそ起源の地であり、その場所が中国である、としました。今回の解析で示された H. lupulus 内の最初の分岐は、ユーラシア大陸の中央部から東部の内陸地帯と推定されています。ヨーロッパ型、中国型、日本型といった各タイプが集まる地域、すなわちこれらの系統が交わる場所が H. lupulus の起源の地であり、それもまた中国となるのです。
分岐年代の推定
各集団間の塩基の違いをもとに、分子進化時計仮説を使って時間軸上に展開してみましょう。そのためには、まず「塩基置換速度」という時計の針をキャリブレーション(較正)する必要があります。その手順についてはノート5-2を参照してください。
解析の結果、今回対象とした葉緑体DNA非コード領域の塩基置換速度は 0.93 × 10⁻⁹ per site per year となりました。
この値を見て「これが速度なのか?」と違和感を持たれるかもしれません。しかし、進化の時間は何万年、何十万年、あるいは何百万年という長いスケールで考える必要があります。
たとえば10万年を10⁵年とすると、上記の値は次のように書き換えられます。
0.93 × 10⁻³ per site per 0.1 million years。
さらに、調べた塩基数が1 kb(= 1,000 bp)であれば、
0.93 per 1 kb per 0.1 million years となります。
つまり、1,000個の塩基を調べた場合、10万年あたりに平均0.93個の塩基の違いが検出される、という意味になります。
この速度をもとに、ホップの各地域集団に適用した結果を示したのが表5-2です。
ヨーロッパ集団の最初の分岐は、およそ105~127万年前と推定されました。その後、中国、日本、北米への分岐は46~69万年前に起こったと考えられ、比較的最近の出来事といえます。しかし、これらの分岐の順番を明確に決定することはできませんでした。
北米の集団は、日本集団と中国集団の両方に由来している可能性があります。北米集団のDNA多様性が高いのは、起源が二つあるためと考えるのが妥当でしょう。そして、分岐の順番を特定できなかった原因も、この二重の起源にあると考えられます。
ホップ伝播のシナリオ
ホップは中国の中央部あるいは東部を起源とし、その誕生の時期は H. lupulus と H. japonicus が分岐した約638万年前から、H. lupulus 内で最初の分岐が起こったヨーロッパ集団の105~127万年前までの間と考えられます(ノート5-2)。
H. japonicus と分岐した初期のホップからは、まずヨーロッパ集団が枝分かれし、中国西部からユーラシア大陸の西端へと移動していきました。
起源の地に残ったホップは、その後約69万年前に中国集団と日本集団に分かれます。
さらに、ほぼ同時期に中国集団から最初の北米集団が、やや遅れて約46万年前には日本集団から第二の北米集団が分岐しました。
中国・日本・北米の各集団の分岐年代にはおよそ20万年の誤差があるため、これらはほぼ同時期に起こったと考えるのが妥当でしょう。
北米集団はベーリング海峡を経て北米大陸へと移動していったと推定されます。
東アジアから北米にまたがって分布する植物は数多く知られており、氷河期に海面が低下して現れたベーリング地峡(Bering Land Bridge)を通じて生物が行き来していた時期がありました。
東アジアと北米に共通する植物の分岐年代は、7,000万年前から新生代第4紀(160万年前以降)にまで及びます(Wen ら 2016)。
たとえばナンブソウ (Achlys japonica) は30~170万年前、クジャクシダ類 (Adiantum) は52~211万年前および28~141万年前(Lu ら 2011)、コウモリカズラ類 (Menispermum) は28万年以内と推定されており、比較的最近に分岐した植物も複数あります(Xiang ら 2000)。
北米ホップ集団とアジア集団の分岐年代はこれらと一致しており、東アジアから北米への移動・分布拡大も、他の植物と同様に自然な現象として説明できます。
一方、ホップのヨーロッパへの移動については、やや異なる様相を呈します。
ヨーロッパにホップをもたらしたのは古代フィンランド人であるという説があります(Korpelainen & Pietiläinen 2021)。
フィンランドで古くから伝承されてきた叙事詩『カレワラ(Kalevala)』には、その経緯が記されているといわれます。
ホップの歴史を扱った読み物にもたびたび登場する話ですが、カレワラ自体はいわば「昔ばなし」に近いもので、口伝えによって長く伝承され、書物としてまとめられたのは19世紀になってからです。
どこか柳田國男先生の『遠野物語』に通じるところがあります。
ヨーロッパのホップの起源については、4~5世紀の民族移動の際に東方からもたらされたとする説(Moir 2000)もあり、人間が関与した可能性が指摘されています。
では、どのようにすれば人間の介在を確かめることができるのか。
しかも、それが過去の出来事である場合に。
一見、不可能に思えるかもしれません。
しかし、ある前提を満たせば、それを確かめる方法はあります。
マイクロサテライトDNA多型
ゲノムの中には、遺伝子以外の一見何もしていないように見える部分があります。
その中のあちらこちらに、特定の配列様式をもつ「マイクロサテライトDNA」と呼ばれる領域が存在します。
この配列の特徴は、たとえば GAGAGAGAGAGAGA のように GA が7回繰り返されたり、GCGCGCGCGCGCGC のように GC が9回繰り返されるなど、少数の塩基が反復している点にあります。
こうした繰り返し配列は、DNAが複製される際にミスが生じやすく、たとえば GA が6回になったり、GC が10回になったりと、長さの異なる変異が起こります。
この繰り返し配列を含むように PCR を設計すると、長さの異なる2種類のDNA断片、あるいは1種類のDNA断片を検出することができます。
育種の項で述べた遺伝の基礎を思い出してください。前者はヘテロ型、後者はホモ型に対応します。
共優性の遺伝子型として扱える点が特徴であり、遺伝子そのものではないため「DNAマーカー」と呼ばれます。
このようなDNAマーカーは、ゲノム全体に多数散在しています。
マイクロサテライトDNAは、一般に非常に高い情報量をもつ指標として知られています。詳しくはノート5-3を参照してください。
今回、11種類のマイクロサテライトDNAを解析し、合計162種のマーカーを得ました。
これらのマーカーを統計的に処理することで、過去に人間が関与したホップの移動があったのか、あるいはなかったのかを検証できます。
前提となる仮説は次の通りです。
もし人間がホップを持ち運んだとすれば、出発地点のホップ集団のごく一部を運んだはずです。
何千、何百という自生ホップ集団の中から、わずかな個体を選んで持ち出したと考えるのが妥当です。
その個体群が、元の集団と自然交配できないほどの距離を移動し、新しい土地に植えられて、やがて新たなホップ集団へと成長していったと想定します。
この過程で重要なのは、一時的に集団の規模が小さくなるという点です。
植え付けられた少数の個体は世代を重ね、交配によって徐々に増えていきますが、十分な時間が経過しない限り、遺伝子頻度は均衡状態には達しません。
ハーディー・ワインベルグの法則を思い出してください。
少数個体から成長した集団では、遺伝子頻度の均衡がまだ保たれず、DNAマーカーの遺伝子頻度に歪みが生じます。
これを創始者効果(founder effect)と呼びます。同様の現象をボトルネック効果(bottleneck effect)と呼ぶこともありますが、厳密には異なる概念です。ただし集団遺伝学的には、ほぼ同義として扱って差し支えないとされています(Cornuet and Luikart 1996)。
理論的な遺伝的均衡状態からどの程度ずれているかを測定することで、過去に小規模集団化が起こった痕跡を検出することができます。この検出を、ドイツ、チェコ、ポルトガルの各集団およびそれらをまとめた集団で試みました。
結果は「No」、検出できませんでした。
参考までに、地中海地方のクルミ集団では明らかなボトルネック効果が確認されています(Pollegioni ら 2011)。
これは、ここ約2000年の間に人間が「優良」と判断した個体を選抜し、小集団化させた結果と考えられています。
人間の関与を示す痕跡が見つかるかもしれない、と期待して行ったDNA解析でしたが、結果は残念ながら陰性でした。
しかし、このマイクロサテライトDNA解析は、ヨーロッパのホップ集団について新たな疑問を投げかける結果にもなりました。
コーカサス地方のホップ
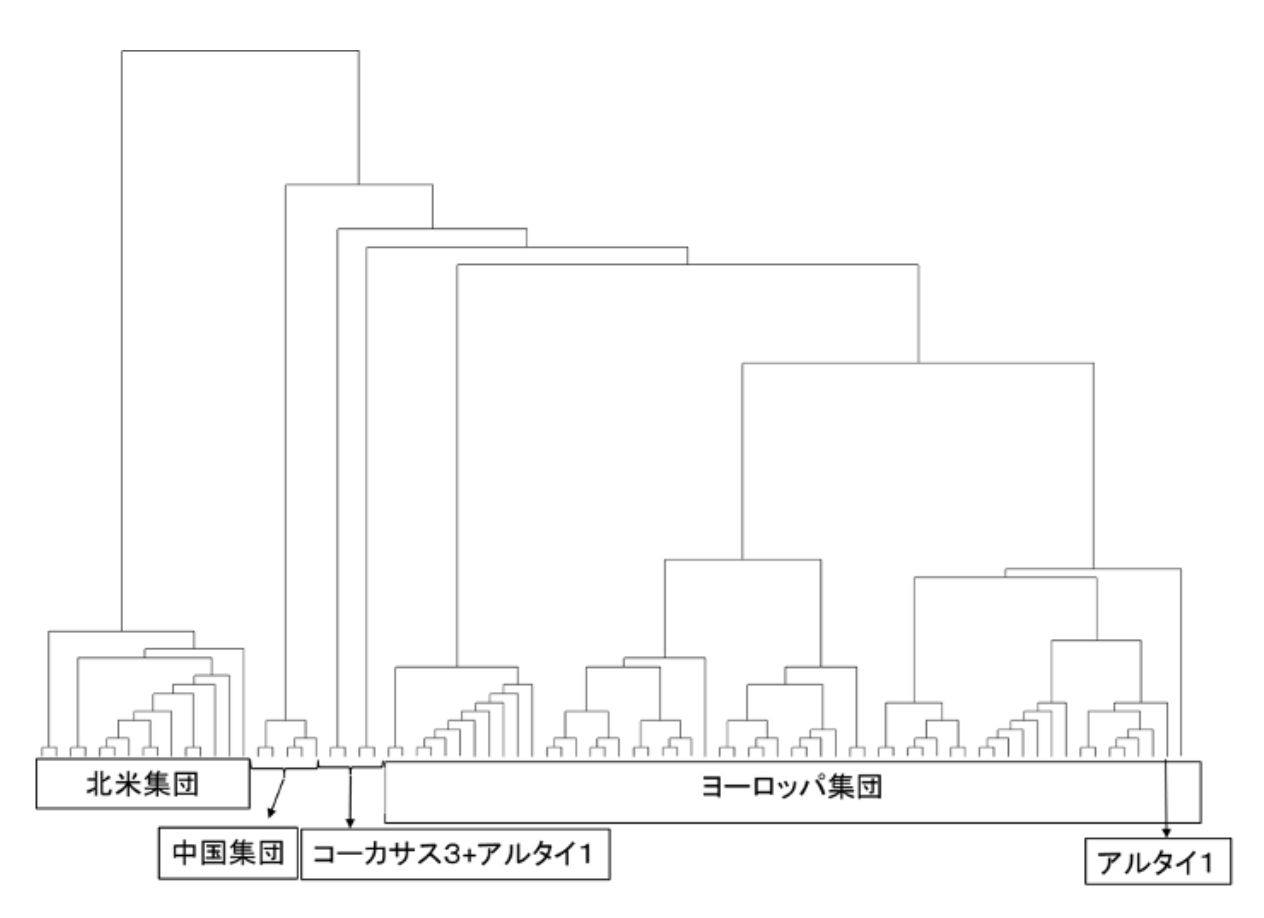
マイクロサテライトDNAの多型を距離データに変換し、系統樹を作成しました(図5-4)。
ヨーロッパ集団は、自生地に関係なく混ざり合ったクラスターを形成していました。
しかし、よく見るとコーカサス地方のホップとアルタイ地方の一部の個体が、他のグループから外れていました。
いずれも2~3個体しか得られなかったため、深い考察はできませんでしたが、氷期の影響、あるいは地理的・気象的な障壁の存在によって、ヨーロッパ集団とコーカサス集団との間で遺伝的交流(すなわち交配)が遮断されていた可能性があると考察しました。
2010年、チェコの Patzak ら(2010a, b)は、コーカサス集団に注目した研究論文を発表しました。
解析に十分な個体数を確保した研究であり、その結果、コーカサス集団は他のヨーロッパ集団とは明らかに異なることが示されました。
最終氷期には、ヨーロッパ北部および中部は氷床に覆われていました。
ホップは生育可能な環境を求めて南下したと考えられます。
ヨーロッパ南部に位置するコーカサス地方が、その避難先となった可能性が高いのです。
およそ1万年前に氷期が終わり、コーカサス地方から北上が始まり、現在の分布に至ったと考えられます。
このように氷期に南下し、氷期の終焉とともに北上する植物の例は数多く報告されています(Ferris ら 1999)。
もし現在のヨーロッパのホップがコーカサス地方に由来するのであれば、両者は遺伝的に多数のマイクロサテライトDNAを共有しているはずであり、図5-4に示したヨーロッパのクラスター内で混ざり合っているはずです。
ところが、実際には完全に分離していました。この事実をどのように説明するかが問題となります。
遺伝的に独立した集団であるということは、長い期間にわたり互いに隔離され、それぞれが独自に進化してきたことを意味します。では、ヨーロッパ集団とコーカサス集団は進化の過程でいつ分岐したのでしょうか。
先述の葉緑体DNAの解析では、ヨーロッパ集団とコーカサス地方の3個体すべてで1塩基の違いが確認されました。
この差異に、塩基置換速度 0.93 × 10⁻⁹ per site per year を用いて計算すると(ノート5-3参照)、両者はおよそ7万〜14万年前に分岐したことが分かりました。
したがって、先に示した「ホップの伝播のシナリオ」に、ヨーロッパ集団の中でこの分岐を新たに付け加える必要があります。
隔離状態にあったということは、育種の項で触れたように、ヨーロッパのホップ品種の変遷にコーカサスのホップは全く関与してこなかったことを意味します(Patzak ら 2010a)。
すなわち、コーカサスのホップは独立した「新たなヨーロッパ・ホップ集団」であったということです。
最後に、アルタイ地方のホップが残された課題として挙げられます。その位置づけはいまだ明確ではありません。
図5-4では、アルタイ地方のホップがヨーロッパ集団およびコーカサス集団の両方に近い位置にありました。
一方で、葉緑体DNAはヨーロッパ集団と同一の型を示していました。
個体数が2つと少ないため、これ以上の考察は推測の域を出ません。この解明は、次の世代の研究者に託したいと思います。
日本の野生ホップ
日本の野生ホップ、カラハナソウの分布調査は、2000年ごろから時間を見つけては続けてきました。北海道から岐阜、滋賀、三重、石川、富山と各地を回りましたが、その分布には大きな偏りがあることが分かりました。詳細は後ほど述べますが、まずは野生ホップがどのような環境に生育しているのかを説明します。
現在の活動拠点である岩手県遠野市は、ホップの一大産地として60年以上の歴史があります。この地域には、野生のホップ(カラハナソウ)に加えて、かつて栽培されていたホップが野生化した個体も見られます。両者は葉の形態や毬花(きゅうか)の形の違いで見分けることができます。
最も明確な違いは「開花期」です。栽培ホップが6月中旬から7月上旬に開花するのに対し、カラハナソウは9月上旬に花を咲かせます。毬花は9月下旬から見られるようになり、10月になると最も見ごろを迎えます。この時期には一目でそれと分かるほど目立ちますが、時期を外すと周囲の緑の植物に埋もれてしまい、注意深く探さないと見つけるのは難しいでしょう。
生育環境にも特徴があります。カラハナソウは日中に日が当たる場所を好み、暗い環境では見つかりません。
したがって、森の奥や深い渓谷のように日照の少ない場所には生育していません。線路の法面、古い道路の法面、道路沿いなど、日当たりの条件が良ければ生育しています。これがカラハナソウを見つけるためのコツです。
図5-5に示したのは、遠野市内で観察されたカラハナソウです。遠野八幡宮の駐車場や、上閉伊酒造ズモナビール工場の庭にも生育しています。後者の個体は雄株です。このように、カラハナソウは身近な場所にひっそりと存在する、親しみ深い野生植物なのです。

左:遠野八幡宮の駐車場(2023年9月21日撮影)
右:上閉伊酒造ズモナビール工場の庭(2023年9月1日撮影)
地元の岩手から始め、北海道、青森、山形、福島、群馬、山梨、長野でカラハナソウを確認しました。空振りは一度もありませんでした。
ただし、群馬で興味深い発見がありました。里の平地では見つからなかったのに、赤城山を登って標高1000メートルを超えたあたりから姿を現したのです。関東平野部は気温が高すぎて適応できず、カラハナソウは標高の高い涼しい環境を選んでいるようです。
高尾山に近い八王子城御主殿跡付近でも確認できました。標高は240メートルと意外に低い場所です。高尾山についてはインターネットの情報から目星をつけ、遠野でホップ農家をしている神山氏に現地確認を依頼しました。彼は多摩出身で、ちょうど里帰りの時期にあたる2023年9月末に調査を行ってくれました。
高尾山の西側、山梨県勝沼に入ると標高は900メートル、さらに長野県美ヶ原では1500メートル。その道中でも次々とカラハナソウを確認できました。しかし、標高が高くなりクマザサが現れるようになると、カラハナソウは見つからなくなりました。生育環境の競合、あるいは気候条件の変化が影響しているのかもしれません。
北海道上富良野のサッポロビールの糸賀氏(ホップの研究仲間)からも興味深い話を聞きました。
「北にはいなくなるよ」とのことでした。
つまり、北海道ならどこにでも生えているわけではなく、カラハナソウには生育できる北限があるようなのです。
長野まで確認できたので、さらに西へ調査範囲を広げました。岐阜、富山、石川、滋賀、三重を回りましたが、一転してすべて空振り。見つける自信があっただけに、非常に落胆したのを覚えています。
長野県では容易に見つかるのに、隣の岐阜ではまったく見つからない。飛騨高山から長野・松本へ抜けるルートを調べて、確信しました。岐阜から峠を越えて長野に入った途端、カラハナソウが現れたのです。
この岐阜と長野の間には、日本アルプスを構成する標高3000メートル級の山々、飛騨山脈、木曽山脈、赤石山脈があります。まさに、カラハナソウの分布を隔てる大きな山の壁となっているのです。
日本野生ホップ「カラハナソウ」の分布
日本アルプスを境に、東と西でカラハナソウの分布が大きく異なるようです。個人の調査だけでは限界があるため、インターネットを通じてカラハナソウの目撃情報を集めてみました。写真付きの投稿も多く、おおよその位置情報を把握することができます。写真を確認し、確かにカラハナソウであることを確認したうえで、市町レベルで位置情報を整理しました。
私の調査では見つけられなかった石川県のほか、まだ訪れたことのない新潟、福井、広島、岡山からも報告がありました。
文献情報も存在します。四国で初めての発見例として、高知県東津野村の天狗高原東側に位置する黒滝山(山中 1994)、
「カラハナソウ中国地方で発見」と題された岡山県新見市での報告(山崎 2000)など、予想外の地域からの記録がありました。これらはいずれも『日本植物学雑誌』に掲載された専門家による報告です。
さらに、石川・福井・広島の各県では、カラハナソウが準絶滅危惧種に指定されています(石川県HP、福井県HP、広島県HP)。遠野ではどこにでも見られるカラハナソウが、これらの地域では「準絶滅危惧種」とされているのは、にわかには信じがたいことです。しかし、これらの県ではカラハナソウの個体数が極端に少ないのが現状です。
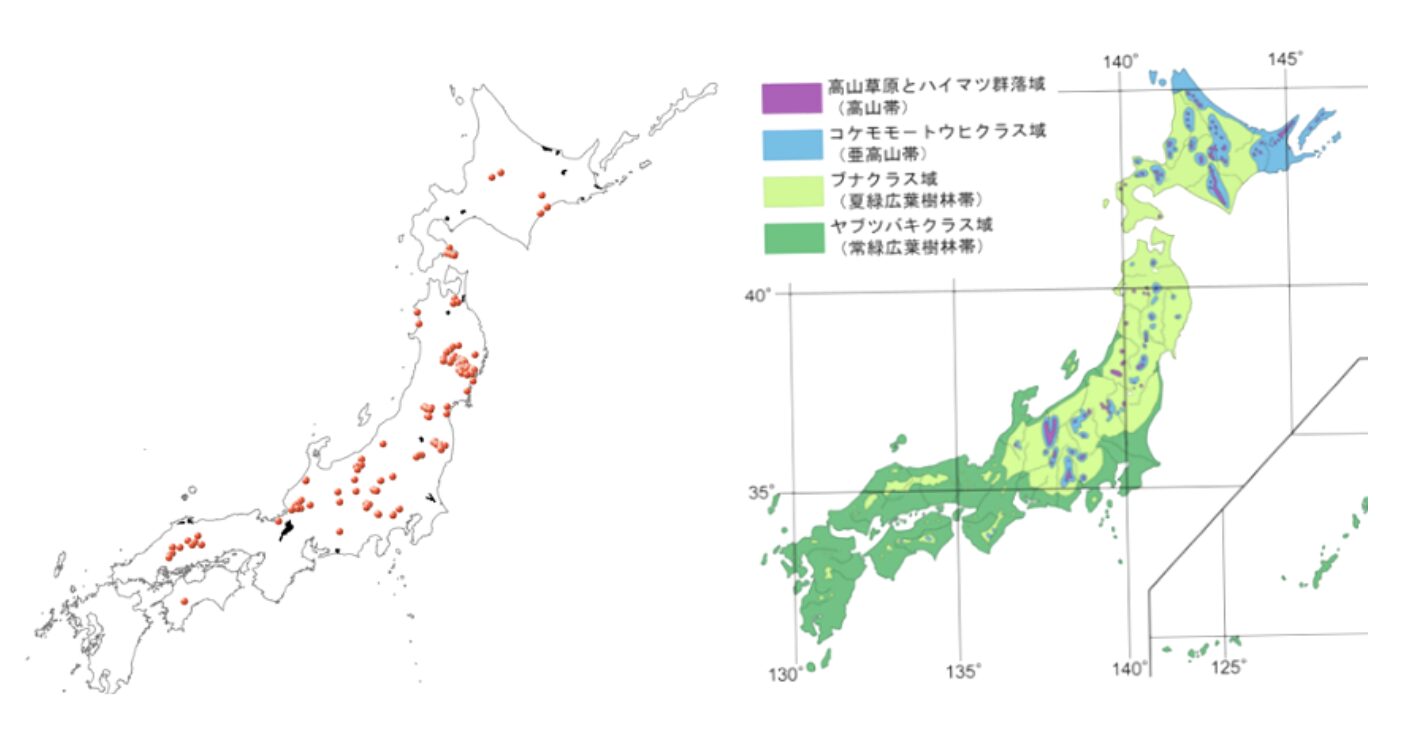
インターネットから集めた位置情報と、自身の現地調査で確認した位置情報を地図上にまとめたものが図5-6左です。
ネット情報では位置をピンポイントで特定できない場合が多いため、任意に3地点(道路沿い)を選び、エリア情報として拡張して示しました。
図5-6右には、生物多様性センターが公開している植生図を示しました(生物多様性センターHP)。日本の植生は大きく4つの区分に分けられています。植生とは、どのような植物種が生育しているかを示すものであり、区分できるということは、明確な境界が存在するということを意味します。
<植生区分>
高山草原とハイマツ群落域 (高山域)
コケモモ-トウヒクラス域 (亜高山域)
ブナクラス域 (夏緑広葉樹林帯)
ヤブツバキクラス域 (常緑広葉樹林帯)
図5-6を見比べると、カラハナソウの分布はブナクラス域とほぼ完全に一致していることが分かりました。
意外に思われた中国・四国地方での分布も、このブナクラス域に重なっており、非常に印象的な結果でした。
右は生物多様性センターHPより引用
カラハナソウの分布をまとめると、
① ブナクラス域(夏緑広葉樹林帯)に自生していること、
② 日本アルプスの東側と西側で個体数に大きな違いがあり、西側では極端に少ないこと、
この二点に整理できます。
なぜこのような分布になったのか。次項でその理由を考察していきましょう。
カラハナソウと氷河期(最終氷期)との関係
参考にしたのは高山植物の研究です。高山植物の起源は北方の高緯度地域にあり、氷期に日本列島が大陸と地続きになった時期に進入してきたと考えられています。過去50万年の間に、地球は5回の氷期と温暖な間氷期を繰り返し、約1万年前に最後の氷期が終わって、現在は間氷期にあります(根井 1990)。
氷期には大量の水が氷として閉じ込められるため海水面が下がり、ユーラシア大陸と日本列島、またユーラシア大陸と北米大陸が地続きとなりました。その結果、動植物の行き来が可能となり、生物の進化や地理的分布に大きな影響を与えたのです。
藤井(2008)は、さまざまな高山植物の葉緑体DNAを調査しています。エゾコザクラでは3つの葉緑体DNAタイプが確認され、それぞれ地理的に分かれた分布を示していました。具体的には、北海道北部からアリューシャン列島にかけての系統、北海道中部から東北にかけての系統、本州中部の系統の3つであり、分岐年代は47万年前から300万年前と幅がありました。
また、本州中部系統ではDNAの多様性が高かったのに対し、それ以外の地域では多型が非常に少なかったと報告されています。この結果の解釈は次の通りです。
多様性の高い中部系統は、古い時期に日本へ進入し、間氷期に標高の高い場所へ隔離されたことで独自の進化を遂げ、多様性が高まった。一方、中部以外の地域では日本への進入が比較的最近であったため、多様性が低い。すなわち、繰り返された氷期のうち、どの時期に日本列島へ進入したかによって、多様性や類縁関係が異なるということです。
地域ごとに分化が確認された高山植物がある一方で、有意な塩基置換が見られない種も多く報告されています(Senni 2005)。これらは日本への進入が比較的最近、しかも一度きりであったと解釈されています。
カラハナソウではどうなるでしょうか。北海道から長野までの葉緑体DNAを解析した結果、違いはまったく見られませんでした。すなわち、日本列島への進入は「最近かつ一度きり」であったと考えられます。
1つの塩基も異ならない期間を、参考として強引に計算してみると、約6.7万年以内(ノート5-4と同様の計算)となります。
これは、最終氷期の時期に進入が起こったことを示唆しています。
では、最終氷期の日本はどのような環境だったのでしょうか。
ネット上で公開されている当時の地図(https://intarch.ac.uk/journal/issue11/rayadams_toc.html)を見ると、氷床が押し寄せていたヨーロッパや北米とは異なり、日本列島周辺は比較的穏やかな環境だったようです。
氷床に追われて南へ逃げてきたというよりも、生育環境を自然に拡大していったという印象です。海面低下によって大陸と地続きになったことで、日本列島へ進入することができ、北海道から東北、関東、そして中部日本へと、自然に分布域を南へ広げていったと考えられます。
しかし、その南下を阻んだのが日本アルプスの高い山々でした。日本アルプスの隆起はおよそ400万年前以降に始まり、飛騨山脈、赤石山脈、木曽山脈の順に形成が進みました。最終氷期にはすでに3000メートル級の山地となっており、険しい地形がそれ以上の南下を許さなかったと考えられます(百原 2017)。
とはいえ、完全に遮断されたわけではありません。ごく少数の個体は、山地を避けるようなルートを通って日本アルプス以西へ到達できた可能性があります。しかし氷期が終わり、現在のような間氷期に入ると、生育に適したブナクラス域(夏緑広葉樹林帯)が限られた地域にしか残らず、そこに辿り着けたカラハナソウはごくわずかだったのでしょう。
これが、カラハナソウの分布から描ける一つのストーリーです。
この章の最後に、2つの論文を紹介します。本章の主な内容は学術誌に投稿し、出版されました。この研究は各地の野生ホップの協力なしには成り立たなかったものであり、感謝の意味も込めて、協力してくれた皆さんを共著者として迎えることを提案したところ、快く承諾をいただきました。
<論文>
Molecular phylogeny of wild hops, Humulus lupulus L., Heredity, 97, 66-74. 2006
Microsatellite DNA analysis of wild hops, Humulus lupulus L., Genet. Resour. Crop Evol., 53, 1553-1562, 2006
<共同著者>
Peter Darby, East Malling Research, Dept. of Hop Research, Wye, Ashford, Kent, England
Branka Javornik, Center for Plant Biotechnology and Breeding, Biotechnical Faculty, University of Ljubljana, Ljubljana, Slovenia
Maria S. S. Pais, Laboratory of Plant Biotechnology – ICAT, Edificio ICAT, Lisbon, Portugal
Elisabeth Seigner and Anton Lutz, Bayer. Landesanstalt für Landwirtschaft, Institut für Pflanzenbau und Pflanzenzuechtung, Arbeitsbereich Hopfen, Wolnzach, Germany
Petr Svoboda, Hop Research Institute Co., Ltd., Zatec, Czech Republic
ここで改めて謝意を表するとともに、歴史ある各研究機関において、長年にわたり野生ホップの収集に尽力された先人の方々に、心から深く敬意を表します。
ノート5-1 PCRの原理
PCRで何が起こっているのかを、以下に示します。
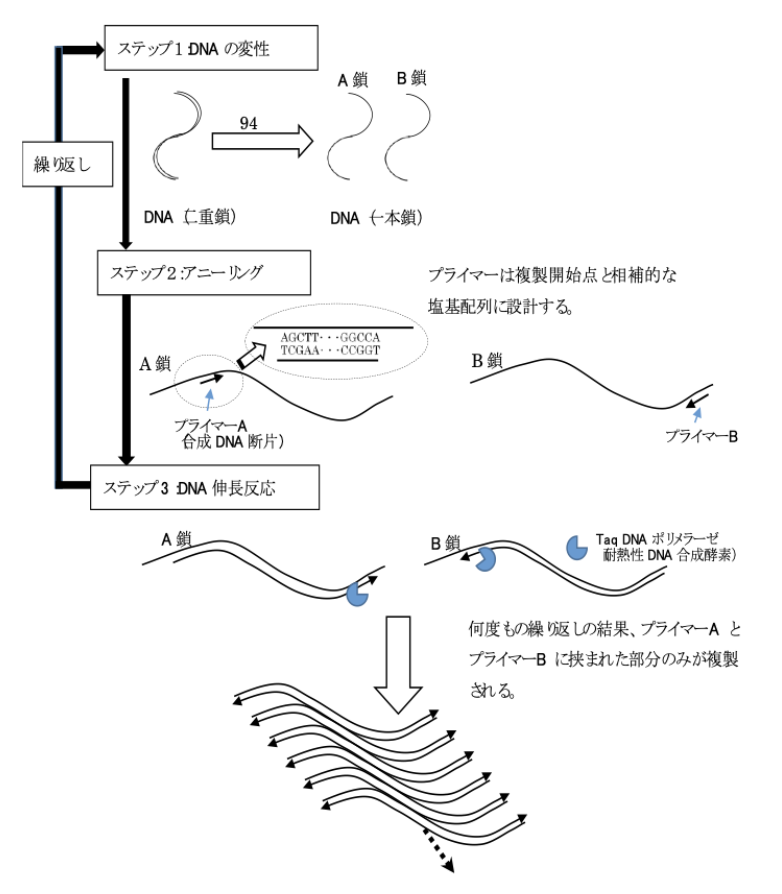
この反応は、たった3つのステップから構成されています。
ステップ1:DNAの変性
DNAは二本鎖の分子構造をしています。まずは、この二重らせんをほどき、一本ずつに分離します。
ステップ2:アニーリング
次に、複製の起点となる「プライマー」と呼ばれる短い合成DNA(約20〜25塩基)を反応させます。
プライマーは、塩基配列が対応する部分に結合し、そこが複製の開始点となります。
ステップ3:DNAの複製・伸長反応
最後に、プライマーを起点としてDNAの複製が進行します。これが1回の反応サイクルです。
この3つのステップを繰り返すことで、反応が連鎖的に進むため「ポリメラーゼ・チェーン・リアクション」と呼ばれています。
さらに、ステップ2では複製の終了点に対応するもう一方のプライマーも同時に反応させます。
その結果、2種類のプライマーに挟まれた部分のみがDNA断片として選択的に複製されます。
プライマーの塩基配列は、目的とするDNA領域の情報をもとに設計することができます。
これにより、試料中に微量しか存在しないDNAから、特定の部分だけを増幅して「見える化」することが可能になるのです。
ステップ1から3までは、温度をコントロールするだけの単純な操作です。しかし問題は、DNA複製を担う酵素、DNAポリメラーゼにあります。この酵素は熱に弱いのです。
ステップ1のDNA変性は、およそ94℃の高温で行われます。ところがこの温度では、DNAポリメラーゼ自体が変性して失活してしまいます。
当初は、異なる温度に設定した3つの加熱装置を用意し、試験管をステップごとに移し替えていたそうです。DNAポリメラーゼも毎回新たに加える必要がありました。非常に手間のかかる作業です。
そこで研究者たちは、熱に強いDNAポリメラーゼを探し始めました。目を付けたのが、温泉の高温の源泉に生息する微生物です。この微生物から見つかったのが、Taq DNAポリメラーゼです。
1986年、この酵素の発見により、PCR反応を自動で繰り返し行う装置の開発が可能となりました。これによって、PCRは一気に実用的で革新的な技術となったのです。
ノート5-2 分子進化時計のキャリブレーション
分岐年代を特定したいのは、ホップとカナムグラの分岐です。この年代が分かれば、Humulus lupulus 内の若い分岐年代を計算することができます。その手順を以下に示します。
解析に利用したのは、植物なら必ず持っている遺伝子、ribulose 1,5-bisphosphate carboxylase Large subunit(rbcL)遺伝子です。これは光合成に関わる酵素の遺伝子です。
通常、アミノ酸をコードする遺伝子は生命活動に直結するため、変異に対して非常に保守的です。
しかし、今回は3番目のコドンに注目しました。3個の塩基の並び(これを「コドン」と呼びます)が1つのアミノ酸に対応しており、最初の2個の塩基でほぼアミノ酸が決まり、3番目は“遊び”のような位置にあります。
例えば、アラニンというアミノ酸はmRNA上では GCU、GCC、GCA、GCG の4種類のコドンで表されます。最初の2塩基(GC)が同じであれば、3番目の塩基が何であっても同じアミノ酸を指定するのです。このように、3番目の塩基は変異に対して寛容であり、進化的変化を検出するのに適しています。
そこで、ホップとカナムグラのrbcL遺伝子におけるコドン第3塩基の置換率を調べました。検定の結果、分子進化時計仮説を適用できることが確認されました。
塩基置換速度としては、Xiang ら(2000)が推定した 1.23 × 10⁻⁹ per site per year を採用しました。この速度をもとに計算すると、ホップとカナムグラの分岐はおよそ 638万年前 に起こったことが分かりました。
なお、この値はrbcL遺伝子での結果です。葉緑体DNAの非コード領域での値に換算したところ、最終的に 0.93 × 10⁻⁹ per site per year を得ました。これが葉緑体DNA非コード領域の塩基置換速度として採用した値です。
ノート5-3 マイクロサテライトDNA多型
マイクロサテライトDNAの情報量の多さについて説明します。
あるマイクロサテライトDNAマーカーを A とします。このマーカーは遺伝子として扱うこともできるため、ある遺伝子座(遺伝子が位置する染色体上の場所と理解してください)に A という遺伝子があるとします。
このマーカーには、塩基の繰り返し回数が異なる6種類のタイプ、すなわち6種類の対立遺伝子が存在すると仮定します。
それらを次のように表記します。
A₁、A₂、A₃、A₄、A₅、A₆
2倍体の生物は、同じ遺伝子座に2つの遺伝子を持っています。したがって、これら6種類の対立遺伝子から2つを取り出してできる組み合わせを考えます。
同じマーカー(ホモ型)の場合:
A₁A₁、A₂A₂、…、A₆A₆ → 6通り
異なるマーカー(ヘテロ型)の場合:
6 × 5 ÷ 2 = 15通り
合計すると、6 + 15 = 21通り の組み合わせになります。
つまり、この1つのマーカーAについて、21種類の遺伝子型が存在することになります。
A₁A₁、A₁A₂、A₁A₃ … A₂A₃、A₂A₄ … A₆A₆ → 計21通り
このように、21種類の遺伝子型の違いが観察されることを、DNAの多型(polymorphism)と呼びます。
ここで、Aに加えてB、Cといった別の遺伝子座を1つずつ増やしてみましょう。
それぞれの遺伝子座にも、Aと同様に6種類の対立遺伝子が存在すると仮定します(遺伝子座の数=n)。
このときの組み合わせ数は、次のように計算されます。

10個の遺伝子座を組み合わせるだけでも、天文学的な数の組み合わせ、すなわち膨大なDNA多型の情報が得られます。
このような性質を利用して、マイクロサテライトDNAは個人の特定にも活用されています。
日本の人口をはるかに超える数の組み合わせが存在するため、偶然、まったく同じマーカーの組み合わせをもつ確率はほぼゼロと言ってよく、その人個人を特定することが可能なのです。
ノート5-4 コーカサス集団とヨーロッパ集団の分岐年代推定
両集団の間には1塩基の違いが認められたため、DNA非コード領域の塩基置換速度として
0.93 × 10⁻⁹ per site per year を用い、分岐年代を計算しました。
その結果、1塩基の違いでは約7.47万年前、2塩基ではなく1.9塩基とすると約14.19万年前となり、両集団はおよそ7万年から14万年前の間に分岐したことになります。
すなわち、最終氷期が始まる以前には、すでに互いに別々の道を歩み始めていたということです。
ただし、この種の計算はあくまで推定であり、手法としてはかなり強引な側面があるため、学術的には厳密とは言えないかもしれません。
引用文献
- Boutain, J. B., On the origin of hops: Genetic variability, phylogenetic relationships, and ecological plasticity of Humulus (Cannabaceae), PhD thesis, University of Hawaii, 2014
- Cournuet, J.M. and Luikart G., Description and power analysis of two test detecting recent population bottlenecks from allele frequency data. Genetics 144:2001-2014. 1996
- Ferris C., King R.A. and Hewitt G. M., Isolation within species and the history of glacial refugia. In: Hollingsworth P.M., Bateman R.M. and Gornall R.J. (Eds), Molecular systematics and plant evolution, Taylor Francis, London, 20-34, 1999
- Korpelainen, H., & Pietilainen, M., Hop (Humulus lupulus L.): Traditional and Present Use, and Future Potential, Economic bot., 75, 3, 302-322, 2021
- Moir, M., Hops-A millennium review, J. Am. Soc. Brew. Chem. 58, 4, 131-146, 2000
- Murakami, A., Darby, P., Javornik, B., Pais, M. S. S., Seigner, E., Lutz, A. and Svoboda, P., Molecular phylogeny of wild hops, Humulus lupulus L., Heredity, 97, 66-74. 2006a
- Murakami, A., Darby, P., Javornik, B., Pais, M. S. S., Seigner, E., Lutz, A. and Svoboda, P., Microsatellite DNA analysis of wild hops, Humulus lupulus L., Genet. Resour. Crop Evol., 53, 1553-1562, 2006b
- Natsume, S., Takagi, H., Shiraishi, A., Murata, J., Toyonaga, H., Patzak, J., Takagi, M., Yaegashi, H., Uemura, A., Mitsuoka, C., Yoshida, K., Krofta, K., Satake, H., Terauchi, R. and Ono, E., The Draft Genome of Hop (Humulus lupulus), an Essence for Brewing, Plant and Cell Physiol., 56, 3, 428-441, 2015
- Nei and Kumar, Molecular evolution and phylogenetics, Oxford University Press, New York, 2000
- Neve, R. A. Hops. Chapman and Hall, London, 1991
- Patzak, J., Nesvadba, V., Krofta, K., Henychova, A., Marzoev, A. I., and Richard, K., Evaluation of genetic variability of wild hops(Humulus lupulus L.) in Canada and the Caucasus region by chemical and molecular methods, Genome, 53, 545-557, 2010a
- Patzak. J., Nesvadba, V., Henychova, A. and Krofta, K., Assessment of the genetic diversity of wild hops (Humulus lupulus L.) in Europe using chemical and molecular analyses, Biochem. Systematics Ecol., 38, 136-145, 2010b
- Pillay, M. and Kenny, S. T., Structure and inheritance of ribosomal DNA variants in cultivated and wild hop, Humulus lupulus L. Theor. Appl. Genet., 93, 333-340, 1996
- Pollegioni, P., Woeste, K., Olimpieri, I., Marandola, D., Cannata, F. and Malvolti, M. E., Long-term human impacts on genetic structure of Italian walnut inferred by SSR markers, Tree Genetics & Genomes, 7, 707–723, 2011
- Senni, K., Fujii, N., Takahashi, H., and Sugawara, T., Intraspecific Chloroplast DNA Variations of the Alpine Plants in Japan, Acta Phytotax. Geobot., 56, 3, 265-275, 2005
- Wen, J., Nie, Z-L., and Ickert-Bond, S. M., Intercontinental disjunctions between eastern Asia and western North America in vascular plants highlight the biogeographic importance of the Bering land bridge from late Cretaceous to Neogene, J. Syst. Evol.54, 5, 469–490, 2016
- Xiang, Q.Y., Soltis, D. E., Soltis, P. S., Manchester, S. R. and Crawford, D. J., Timing the eastern Asian-eastern North American floristic disjunction: Molecular clock corroborates Paleontological estimates, Mol. Phyl. Evol. 15, 462-472, 2000
- 鏡勇吉, 小若雅弘, 山本耕二, ビールの花 ホップ, 東京, 1985
- 根井正利, 分子進化遺伝学, 培風館, 東京, 1990
- 藤井 紀行, 日本産高山植物における本州中部地域の系統地理学的重要性, 分類, 8, 1, 5-14, 2008
- 百原 新, 鮮新・更新世の日本列島の地形発達と植生・植物相の変遷, 第四紀研究, 56, 6, 251-264, 2017
- 山崎敬, カラハナソウ中国地方で発見, J. Japanese Bot., 75, 2, 125. 2000
- 山中二男, 四国のカラハナソウ, J. Japanese Bot., 69, 3, 179, 1994
- 生物多様性センター:http://gis.biodic.go.jp/webgis/sc-009.html
- 石川HP: https://www.pref.ishikawa.lg.jp/sizen/reddata/rdb2020/documents/05_rdb2020_shokubutu_nt_291-336.pdf
- 福井HP: https://www.pref.fukui.lg.jp/doc/shizen/rdb/syokubutu_list_d/fil/448_syoku_p498.pdfおよびhttp://www.erc.pref.fukui.jp/gbank/RDBplant/data_p/plant315.html
- 広島HP: https://www.pref.hiroshima.lg.jp/site/tayousei/j-j2-reddata2-index3.html 内の「被子植物」
目次
はじめに
第1章 ホップの苦味の科学
・はじめに抗菌性あり!
・α酸を貯蔵するルプリンの役割
・ホップの抗菌性
・抗菌性のメカニズム
・ホップの苦味成分たち
・Cohumulone論争
・苦味成分の脇役たち
・フルーツビールの教え
・苦味価とは
・ノート1-1 毬花
・ノート1-2 pH
・ノート1-3 成分の性質
・ノ-ト1-4 分析法について
・引用文献
第2章 ホップの香りの科学
・香り成分分析技術の進歩のおかげ
・ホップとビールでの成分組成の違い
・ホップ香気成分の世界
・香気成分の間に起こる相互作用
・香りはどうように感知されるのか
・香気成分データの解析
・ホップ品種の香気のアイデンティティーはどの様に決まる?
・ノート2-1 テルペン類
・ノート2-2 濃度単位のお話し
・ノート2-3 含硫成分の分析
・ノート2-4 多変量解析
・引用文献
第3章 ホップ使用技術
・ビールの作り方
・苦味の付け方
・ホップ香気の付け方
・ホップの加工・調製品
・生ホップの特徴とは
・ルプリンパウダーの教え
・引用文献
第4章 ホップの育種
・交配育種の始まり
・雄ホップと交配育種
・遺伝の基礎
・ホップの遺伝学
・Cohumulone(Coh)論争の考察
・新ホップ品種MURAKAMI SEVENのいきさつ
・ホップ品種のアイデンティティーとは
・ホップのテロワール
・ノート4-1 遺伝学用語の解説
・ノート4-2 成分比率の実験系の補足
・引用文献
第5章 ホップの進化遺伝学
・分子進化遺伝学
・PCRの登場
・分子進化時計
・野生ホップ収集開始
・世界の野生ホップのDNA解析
・Humulus属の構成
・DNA塩基の違い
・ホップの起源の地
・分岐年代の推定
・ホップの伝播のシナリオ
・マイクロサテライトDNA多型
・コーカサス地方のホップ
・日本の野生ホップ
・日本野生ホップ、カラハナソウの分布
・カラハナソウと氷河期(最終氷期)との関係
・ノート5-1 分子進化時計のキャリブレーション
・ノート5-2 マイクロサテライトDNA多型
・ノート5-3 コーカサス集団とヨーロッパ集団の分岐年代推定
・引用文献
第6章 ホップを取り巻く環境の変化
・ビール事情の変化
・世界のホップ育種事情の変化
・世界のホップ生産事情の変化
・日本のホップ事情
・遠野、Now!
・ホップの新たな可能性-ホップの健康機能性-
・引用文献
付録:ホップの育て方
・成長のフェーズ
・ホップの育て方-作業-
・ホップの育て方-施肥-
・ホップの育て方-病虫害、自然発生被害-
・ホップの収穫
・ホップ栽培、あるある!
・将来のホップ栽培のために
・引用文献
おわりに
※校正しながら連載を進めますので、目次の一部が変更となる可能性があります
お知らせ
連載の更新情報は、GOOD HOPS公式SNS(X・Facebook)で随時お知らせします。
ぜひフォローしてチェックしてください。
X
facebook
また、村上が手がけたGOOD HOPSのビールも現在販売中です。下記のリンクよりご確認ください。
一般の方向けオンラインショップ
業務店さま向けオンラインショップ
お問い合わせ
施設やTAPROOMに関するご質問、自社ビールのお取り扱いに関するお問い合わせ(小売店様・飲食店様向け)、取材のご依頼など、どうぞお気軽にご連絡ください。
スタッフ一同、美味しいビールとともにお待ちしております!



